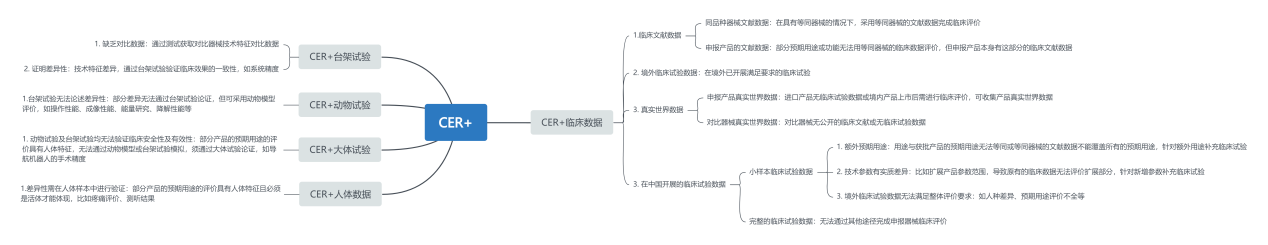
临床评估过程的文件被称为临床评价报告(CER),不同的产品情况可选择不同的临床评价形式,当前NMPA可通过同品种比对和临床试验的形式完成CER。完成一份CER需要多方数据支持如动物试验数据、台架试验数据、大体试验数据、临床文献数据、临床试验数据等等。
近年来,越来越多的产品通过同品种的方式完成CER,特别是成像类、物理治疗类的器械。NMPA也在持续更新临床评价推荐路径,更多的产品被推荐选择以同品种的形式进行临床评价。截止目前,需要进行临床评价的产品中推荐路径为同品种的器械占比为47.86%。相信未来也会有更多的产品被推荐采用同品种的方式进行临床评价。
监管类别 | I | II | III |
器械数量 | 431 | 861 | 458 |
免临床 | 431 | 609 | 102 |
同品种 | / | 116 | 175 |
临床试验 | 127 | 173 | |
未明确路径 | 9 | 8 |
完成CER的数据来源是多种形式的,CIRS根据项目经验汇总了一些不同数据在CER过程中的应用场景。在实际应用过程中,一个产品的CER可能会涉及多种情形,因此“CER+”的组合也可能是多重的。后续CIRS也会结合案例分析“CER+”的实际应用。